De nombreux protozoaires vivent dans le corps humain. Beaucoup d'entre eux sont pathogènes. Notre histoire en est une dizaine, la plus importante. La revue est basée sur des publications historiques et récentes.
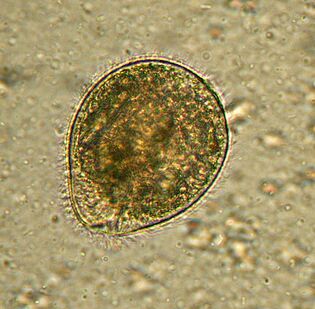
Le plus grand. BalantidiumBalantidium coli
Le plus gros protozoaire est un parasite humain et le seul cilié de cette société. Ses dimensions varient de 30 à 150 microns de longueur et de 25 à 120 microns de largeur. A titre de comparaison: la longueur du plasmodium paludéen au stade le plus grand est d'environ 15 microns, et plusieurs fois plus courte que le balantidium des cellules intestinales, parmi lesquelles vivent les ciliés. Un éléphant dans un magasin de porcelaine.
Distribuépartout où il y a des porcs - ses principaux vecteurs. Il vit généralement dans la sous-muqueuse du côlon, bien que chez l'homme, il se trouve également dans l'épithélium pulmonaire. Il se nourrit de bactériesB. coli, de particules de nourriture, de fragments d'épithélium de l'hôte. Chez les animaux, l'infection est asymptomatique. Les personnes peuvent développer une diarrhée sévère avec écoulement sanglant et visqueux (balantidiase), parfois des ulcères se forment dans les parois du côlon. Il est rare de mourir de balantidose, mais cela provoque un épuisement chronique.
Les gens sont infectés par de l'eau sale ou des aliments contenant des kystes. Le taux d'infection chez l'homme ne dépasse pas 1%, tandis que les porcs peuvent être infectés partout dans le monde.
traitéavec des antibiotiques, aucun rapport de résistance aux médicaments n'a encore été rapporté pour ce cilié.
Découvertpar le scientifique suédois Malstem en 1857. Aujourd'hui, la balantidose est associée aux zones tropicales et subtropicales, à la pauvreté et au mauvais assainissement.
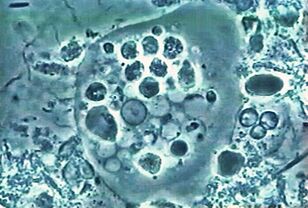
Le premier. Amibe oraleEntamoeba gingivalis
La première amibe parasite trouvée chez l'homme. La description des amibes a été publiée en 1849 dans la plus ancienne revue scientifique. On trouve de l'amibe dans la plaque dentaire, d'où le nom du latin gencives - gencives.
Vitdans la bouche de presque tous ceux qui ont mal aux dents ou aux gencives douloureuses, réside dans les poches de gencives et la plaque. Il se nourrit de cellules épithéliales, de leucocytes, de microbes et en cas d'érythrocytes. Il est rare chez les personnes ayant une cavité buccale saine.
Ce petit protozoaire, d'une taille de 10 à 35 µm, ne sort pas dans l'environnement et ne forme pas de kystes, il est transmis à un autre hôte en l'embrassant, à travers de la vaisselle sale ou des aliments contaminés.E. gingivalisest considéré comme un parasite exclusivement humain, mais on le trouve parfois chez les chats, chiens, chevaux et singes captifs.
Au début du 20e siècle,E. gingivalisétait décrit comme l'agent causal de la maladie parodontale, car il est toujours présent dans les cellules dentaires enflammées. Cependant, sa pathogénicité n'a pas été prouvée.
Les médicamentsaffectant cette amibe sont inconnus.
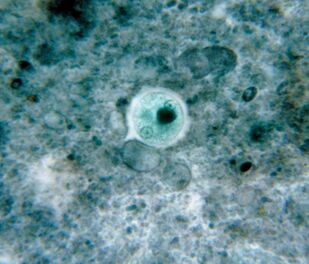
Le plus répandu. Dysenterie AmebaEntamoeba histolytica
Ce parasite intestinal avec du sang pénètre dans les tissus du foie, des poumons, des reins, du cerveau, du cœur, de la rate, des organes génitaux. Mangez ce qu'il contient: particules de nourriture, bactéries, globules rouges, leucocytes et cellules cutanées.
Distribuépartout, en particulier sous les tropiques. Habituellement, les gens sont infectés en avalant un kyste.
Dans les pays tempérés, l'amibe a tendance à rester dans la lumière intestinale et l'infection est asymptomatique. Dans les régions tropicales et subtropicales, le processus pathologique commence souvent:E. histolyticaattaque les murs. Les raisons du passage à la forme pathogène ne sont pas encore claires, mais plusieurs mécanismes moléculaires de ce qui se passe ont déjà été décrits. Ainsi, il est clair que les amibes sécrètent des substances lysantes, percent le mucus et tuent les cellules. Apparemment, l'amibe peut détruire la cellule hôte de deux manières: en y déclenchant l'apoptose ou en mâchant simplement des morceaux. La première méthode a longtemps été considérée comme la seule. À propos, le mécanisme du suicide cellulaire à une vitesse record - en quelques minutes - n'a pas été identifié. La deuxième méthode a été décrite assez récemment, les auteurs l'ont appelée trogocytose du grec «trois» - ronger. Fait intéressant, les amibes qui piquent les cellules abandonnent leur proie dès qu'elle meurt. D'autres peuvent engloutir complètement les cellules mortes. On suppose que les cellules mordantes et dévorantes diffèrent dans le modèle d'expression génique.
Maintenant, la capacité de l'amibe à pénétrer dans la circulation sanguine, le foie et d'autres organes est associée à la troocytose.
L'amibiase est une maladie mortelle, avec environ 100 000 personnes décédant chaque année d'une infection àE. histolytica.
L'amibe dysenteuse a un jumeau non pathogène,E. dispar, donc la microscopie n'est pas suffisante pour diagnostiquer la maladie.
Pour guérirdoit être détruit sous forme de celluleE. histolyticaet de kystes.
Il a décritE. histolyticaet a déterminé son caractère pathogène en 1875 chez un patient souffrant de diarrhée. Le nom latin de l'amibe a été donné en 1903 par le zoologiste allemand Fritz Schaudin.Histolyticasignifie destructeur pour les tissus. En 1906, le scientifique est mort d'un abcès intestinal amibien.
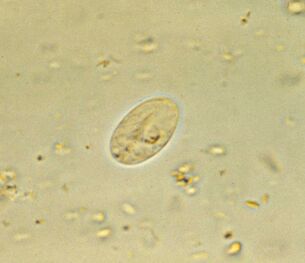
Le plus courant. Lamblia intestinaleGiardia lamblia (G. intestinalis)
Giardia, le parasite intestinal le plus courant, est omniprésent. 3 à 7% des habitants des pays développés et 20 à 30% des pays en développement sont infectés. Cela représente environ 300 millions de personnes.
Les parasites viventdans le duodénum et les voies biliaires de l'hôte, où ils flottent, travaillant avec les flagelles, puis se fixent à l'épithélium à l'aide d'un disque collant situé sur la face inférieure ducellule. Pour 1 cm2, l'épithélium adhère à un million de lamblias. Ils endommagent les villosités, qui interfèrent avec l'absorption des nutriments, provoquant une inflammation de la muqueuse et de la diarrhée. Si la maladie affecte les voies biliaires, elle s'accompagne d'une jaunisse.
La giardiase est une maladie des mains sales, de l'eau et de la nourriture. Le cycle de vie d'un protozoaire est simple: dans l'intestin, il existe une forme active et à la sortie avec des masses fécales, des kystes stables. Pour être infecté, il suffit d'avaler une douzaine de kystes, qui dans l'intestin se transformeront à nouveau en une forme active.
Le principal secretde l'ubiquité de la lamblia dans la variabilité des protéines de surface. Le corps humain combat la lamblia avec des anticorps et, en principe, est capable de développer une immunité. Mais les personnes qui vivent dans la même région et boivent la même eau sont continuellement infectées par les descendants de leurs propres parasites. Pouquoi? Car lors du passage de la phase active au kyste et vice versa, la lamblia modifie les protéines contre lesquelles les anticorps sont produits, des protéines de surface spécifiques des variants. Il existe environ 190 variantes de ces protéines dans le génome, mais une seule est toujours présente à la surface d'un seul parasite; la traduction du reste est interrompue par le mécanisme d'interférence ARN. Et le changement se produit environ une fois toutes les dix générations.
Est traitéavec un agent antiprotozoaire à activité antibactérienne. La maladie disparaît en une semaine, mais si les voies biliaires sont infectées, des rechutes sont possibles pendant de nombreuses années. Les kystes sont combattus avec de l'eau iodée.
DécouverteGiardia lambliaen 1859 par le scientifique tchèque Vilém Lambl. Depuis lors, le plus simple a changé plusieurs noms, et l'actuel a été reçu en l'honneur du découvreur et parasitologue français Alfred Giar, qui n'a pas décrit la lamblia.
Et le premier croquis de Giardia a été réalisé par Anthony van Leeuwenhoek, qui l'a trouvé dans son fauteuil désemparé. C'était 1681.
Au fait, Giardia est également très ancienne sur le plan de l'évolution, dérivant presque directement de l'ancêtre de tous les eucaryotes.
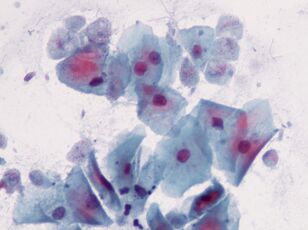
Le plus intime. Trichomonas vaginalisTrichomonas vaginalis.
Le plus simple, qui est transmis sexuellement. Il vit dans le vagin et chez les hommes - dans l'urètre, l'épididyme et la prostate, il est transmis sexuellement ou par des lingettes humides. Les bébés peuvent être infectés en passant par le canal génital.T. vaginalisa 4 flagelles à l'extrémité antérieure et une membrane ondulée relativement courte; si nécessaire, il libère des pseudopodes. La taille maximale des Trichomonas est de 32 x 12 microns.
Trichomonas est pluscommunque les agents responsables de la chlamydia, de la gonorrhée et de la syphilis. Elle touche environ 10% des femmes, et peut-être plus, et 1% des hommes. Ce dernier chiffre n'est pas fiable car il est plus difficile de détecter le parasite chez l'homme.
T. vaginalisse nourrit de micro-organismes, y compris les bactéries lactiques de la microflore vaginale, qui maintiennent un environnement acide et créent ainsi un pH optimal pour lui-même au-dessus de 4, 9.
Trichomonas détruit les cellules muqueuses, provoquant une inflammation. Environ 15% des femmes infectées se plaignent de symptômes.
Est traitéavec un médicament antibactérien. À titre préventif, il est recommandé de se laver régulièrement avec du vinaigre dilué.
Décriten 1836 par le bactériologiste français Alfred Donne. Le scientifique n'a pas compris qu'il y avait un parasite pathogène devant lui, mais il a déterminé la taille, l'apparence et le type de mouvement du plus simple.
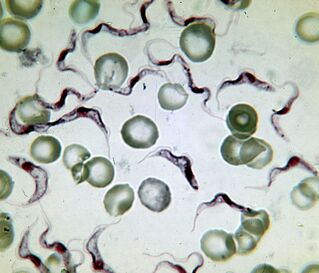
Le plus mortel. L'agent causal de la maladie du sommeilTrypanosoma brucei
L'agent causal de la maladie du sommeil africaine est le protozoaire le plus meurtrier. Une personne infectée meurt sans traitement. Le trypanosome est un flagellé allongé de 15–40 µm de long. Il existe deux sous-espèces indiscernables de l'extérieur. Maladie causée parT. brucei gambiense, dure 2 à 4 ans.T. brucei rhodesienseest un pathogène transitoire plus virulent dont ils meurent après quelques mois ou semaines.
Répartisen Afrique, entre les quinzièmes parallèles des hémisphères sud et nord, dans le rayon naturel du vecteur - insectes hématophages du genreGlossina(mouche tsé-tsé). Sur les 31 espèces de mouches, 11 sont dangereuses pour les humains. La maladie du sommeil touche la population de 37 pays au sud du Sahara à 9 millions de km2. Jusqu'à 20 000 personnes tombent malades chaque année. Il y a maintenant environ 500 000 patients, 60 millions vivant à risque.
De l'intestin de la moucheT. bruceipénètre dans la circulation sanguine humaine, de là, il pénètre dans le liquide céphalo-rachidien et affecte le système nerveux. La maladie commence par de la fièvre et une inflammation des ganglions lymphatiques, suivies de la léthargie, de la somnolence, de la paralysie musculaire, de l'émaciation et du coma irréversible.
La létalité du parasite est associée à sa capacité à traverser la barrière hémato-encéphalique. Les mécanismes moléculaires ne sont pas entièrement compris, mais on sait que lorsqu'il pénètre dans le cerveau, le parasite sécrète des cystéine protéases et utilise également certaines protéines hôtes. Dans le système nerveux central, en revanche, le trypanosome se répare des facteurs immunitaires.
La première description de la maladie du sommeil dans la partie supérieure du Niger a été laissée par le savant arabe Ibn Khaldun (1332-1406). Au début du XIXe siècle, les Européens étaient déjà bien conscients du signe initial de la maladie - gonflement des ganglions lymphatiques à la nuque (un symptôme de Winterbottom), et les marchands d'esclaves y ont prêté une attention particulière.
DécouverteT. bruceiLe microbiologiste écossais David Bruce, dont il tire son nom, et en 1903 établit pour la première fois le lien entre le trypanosome, la mouche tsé-tséet la maladie du sommeil.
LeTraitementdépend du stade de la maladie et les médicaments provoquent des effets secondaires graves. Le parasite a une forte variabilité antigénique, il est donc impossible de fabriquer un vaccin.
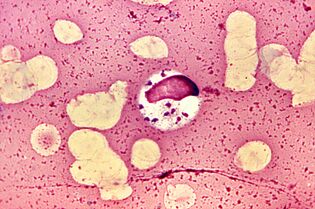
Le plus extravagant. LeishmaniaLeishmania donovani
Leishmania a gagné le titre de parasites les plus extravagants, car ils vivent et se reproduisent dans des macrophages, des cellules conçues pour détruire les parasites.L. donovaniest le plus dangereux d'entre eux. Il provoque une leishmaniose viscérale, familièrement dumdum ou fièvre kala-azar, dont presque tous les patients meurent sans traitement. Mais les survivants acquièrent une immunité à long terme.
Il existe trois sous-espèces du parasite.L. donovani infantum(Méditerranée et Asie centrale) affecte principalement les enfants, les chiens en sont souvent le réservoir.L. donovani donovani(Inde et Bangladesh) est dangereux pour les adultes et les personnes âgées, n'a pas de réservoirs naturels. L'AmériqueL. donovani chagasi(Amérique centrale et du Sud) peut vivre dans le sang des chiens.
L. donovani- flagellés ne dépassant pas 6 microns de longueur. Les gens sont infectés après avoir été piqués par des moustiques commePhlebotomus, parfois par contact sexuel, des bébés - passant par le canal génital. Une fois dans le sang,L. donovanipénètre dans les macrophages, qui transportent le parasite à travers les organes internes. En se reproduisant dans les macrophages, le parasite les détruit. Le mécanisme moléculaire de survie dans les macrophages est assez complexe.
Symptômes de la maladie- fièvre, hypertrophie du foie et de la rate, anémie et leucopénie, qui contribuent à une infection bactérienne secondaire. Chaque année, 500 000 personnes sont atteintes de leishmaniose viscérale et environ 40 000 en meurent.
Traitement lourd- administration intraveineuse de préparations d'antimoine et de transfusions sanguines.
L'appartenance taxonomiqueL. donovania été définie en 1903 par le célèbre chercheur sur le paludisme et lauréat du prix Nobel Ronald Ross. Il doit son nom générique à William Leishman, et son nom spécifique à Charles Donovan, qui dans le même 1903 découvrit indépendamment des cellules protozoaires dans la rate de patients morts de kala-azar, l'un à Londres, l'autre à Madras.
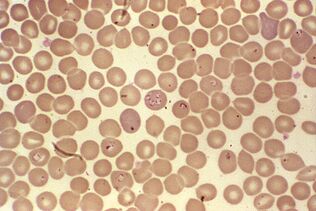
Le cycle de vie le plus difficile.Babesia spp.
Babesias, en plus de la reproduction asexuée en plusieurs étapes dans les érythrocytes de mammifères et les acariens sexuels dans l'intestin du genreIxodes, ont compliqué leur développement par transmission transovarienne. À partir de l'intestin d'une tique femelle, les sporozoïtes des protozoaires pénètrent dans les ovaires et infectent les embryons. Lorsque les larves d'acariens éclosent, la babésia passe dans ses glandes salivaires et, dès la première morsure, pénètre dans le sang des vertébrés.
DistribuéBabesia en Amérique, en Europe et en Asie. Leur réservoir naturel sont les rongeurs, les chiens et le bétail. Une personne est infectée par plusieurs types: B. microti, B. divergens, B. duncanietB. venatorum.
Les symptômes de la babésiose sont similaires à ceux du paludisme: fièvre récurrente, anémie hémolytique, hypertrophie de la rate et du foie. La plupart des gens se rétablissent spontanément, mais la babésiose est mortelle pour les patients dont le système immunitaire est affaibli.
LesLes méthodes de traitementsont encore en cours de développement, tandis que des antibiotiques et, dans les cas graves, des transfusions sanguines sont prescrits.
Babesia a été décrite par le microbiologiste roumain Victor Babes (1888), qui l'a découverte chez des vaches et des moutons malades. Il a décidé qu'il avait affaire à une bactérie pathogène qu'il a appeléeHaematococcus bovis. Babesia a longtemps été considérée comme un agent pathogène animal jusqu'à ce qu'elle soit découverte en 1957 chez un berger yougoslave décédé d'une infection à B. divergens.
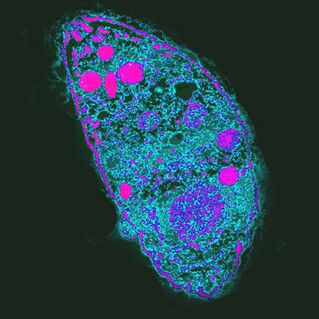
Le plus influent. L'agent causal de la toxoplasmoseToxoplasma gondii
T. gondiiest le parasite le plus puissant car il contrôle le comportement des hôtes intermédiaires.
Distribuépartout, inégalement distribué. En France, par exemple, 84% de la population est infectée, au Royaume-Uni 22%.
Le cycle de vie de Toxoplasma se compose de deux étapes: asexuée se produit dans le corps de tout sang chaud, la reproduction sexuée n'est possible que dans les cellules épithéliales de l'intestin du chat. PourT. gondiipourrait terminer son développement, le chat doit manger un rongeur infecté. En augmentant la probabilité de cette occurrence,T. gondiibloque la peur naturelle des rongeurs de l'odeur d'urine de chat et le rend attrayant en ciblant un groupe de neurones dans l'amygdale. Comment cela fonctionne-t-il? L'un des prétendus mécanismes d'action est une réponse immunitaire locale à l'infection. Il modifie les niveaux de cytokines, ce qui augmente à son tour les niveaux de neuromodulateurs tels que la dopamine. Le toxoplasme affecte également le comportement humain, qui se manifeste également au niveau de la population. Ainsi, dans les pays à fort taux de toxoplasmose, de névrosisme et de volonté d'éviter l'incertitude, de nouvelles situations sont plus fréquentes. Il est possible que l'infection àT. gondiientraîne des changements culturels.
L'infectionchez l'homme est souvent asymptomatique, mais avec une immunité affaiblie, elle détruit les cellules du foie, des poumons, du cerveau, de la rétine, provoquant une toxoplasmose aiguë ou chronique. L'évolution de l'infection dépend de la virulence de la souche, de l'état du système immunitaire de l'hôte et de son âge - les personnes âgées sont moins sensiblesT. gondii.
Traitela toxoplasmose avec des médicaments antiprotozoaires.
Décriten 1908 chez les rongeurs du désert. Cet honneur revient au personnel de l'Institut Pasteur de Tunisie Charles Nicolas et Luis Manso.
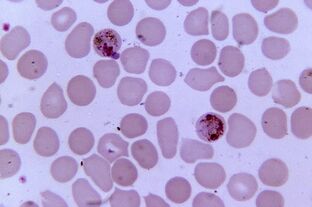
Plus pathogène. Paludisme à PlasmodiumPlasmodium spp.
Le paludisme à Plasmodium est le parasite le plus pathogène chez l'homme. Le nombre de patients atteints de paludisme peut atteindre 300 à 500 millions et le taux de mortalité pendant les épidémies - 2 millions. La maladie fait encore trois fois plus de vies que les conflits armés.
Cinq types de Plasmodium causent le paludisme chez l'homme:Plasmodium vivax, P. falciparum, P. malariae, P. ovaleetP. knowlesi, qui affecte égalementles macaques.
Distribuédans la gamme des vecteurs - les moustiquesAnophèles, qui nécessitent une température de 16 à 34 ° C et une humidité relative supérieure à 60%.
La comparaison du génome du plasmode le plus virulent,P. falciparum, avec le plasmode du gorille suggère que l'homme a été infecté par son ancêtre par ces singes. L'émergence de cette forme de Plasmodium est associée à l'émergence de l'agriculture en Afrique, qui a conduit à une augmentation de la densité de population et au développement de systèmes d'irrigation.
La reproduction sexuée des plasmodes se produit dans les intestins des moustiques et dans le corps humain, c'est un parasite intracellulaire qui vit et se reproduit dans les hépatocytes et les érythrocytes jusqu'à ce que les cellules éclatent. 1 ml de sang du patient contient 1 à 50 000 parasites.
La maladie se manifeste par une inflammation, une fièvre périodique et une anémie, en cas de grossesse, elle est dangereuse pour la mère et le fœtus. Les globules rouges infectés parP. falciparumobstruent les capillaires et dans les cas graves, une ischémie des organes internes et des tissus se développe.
LeTraitementnécessite une combinaison de plusieurs médicaments et dépend du pathogène spécifique. Les plasmodes deviennent résistants aux médicaments.








































